補(bǔ)體C5a對腎移植排斥反應(yīng)中IL-17產(chǎn)生的調(diào)節(jié)作用*
李蜀婧,鄭權(quán)友,袁 剛,霍文謙,張克勤
(第三軍醫(yī)大學(xué)大坪醫(yī)院野戰(zhàn)外科研究所泌尿外科,重慶 400042)
補(bǔ)體C5a對腎移植排斥反應(yīng)中IL-17產(chǎn)生的調(diào)節(jié)作用*
李蜀婧,鄭權(quán)友,袁 剛,霍文謙,張克勤△
(第三軍醫(yī)大學(xué)大坪醫(yī)院野戰(zhàn)外科研究所泌尿外科,重慶 400042)
目的探討腎移植排斥反應(yīng)中促炎性細(xì)胞因子白細(xì)胞介素17(IL-17)和補(bǔ)體活化產(chǎn)物C5a的表達(dá)情況,以及C5a對IL-17表達(dá)的可能調(diào)節(jié)作用?方法 流式細(xì)胞術(shù)(FCM)檢測腎移植患者外周血中IL-17+T細(xì)胞的頻率和C5a刺激后人腎小管上皮細(xì)胞系中的HK2細(xì)胞IL-17的表達(dá)情況;ELISA檢測腎移植患者血清C5a水平的變化;免疫組織化學(xué)檢測并比較正常腎組織和發(fā)生排斥反應(yīng)移植腎組織中IL-17的表達(dá)和補(bǔ)體C5b-9的沉積;免疫細(xì)胞化學(xué)檢測HK2細(xì)胞在重組C5a刺激前?后IL-17表達(dá)的差異?結(jié)果同種異基因腎移植術(shù)后,腎移植患者外周血中IL-17+T細(xì)胞百分率明顯升高,患者血清C5a水平較術(shù)前顯著增加(P0.01);發(fā)生排斥反應(yīng)的腎組織中IL-17表達(dá)與C5b-9的沉積較正常腎臟組織均有明顯的上調(diào),二者呈正相關(guān);加入重組的C5a刺激后,HK2細(xì)胞IL-17的表達(dá)水平顯著上調(diào)?結(jié)論腎移植排斥反應(yīng)中補(bǔ)體活化產(chǎn)物C5a可能對IL-17的產(chǎn)生起正向調(diào)節(jié)作用?
補(bǔ)體C5a;白細(xì)胞介素17;腎移植;移植物排斥
白細(xì)胞介素17(interleukin-17,IL-17)是一種重要的促炎性細(xì)胞因子[1-2],除了CD4+T亞群外,其他許多細(xì)胞亞群如:CD8+T亞群,細(xì)胞和中性粒細(xì)胞等均可分泌IL-17[3]?有研究顯示,IL-17在器官移植術(shù)后急?慢性排斥反應(yīng)中有著重要的作用[4-6]?同時,在移植排斥反應(yīng)中,移植抗原與抗體結(jié)合可激活補(bǔ)體系統(tǒng)?作為補(bǔ)體系統(tǒng)的樞紐分子,C5被激活后可裂解形成C5a和C5b?C5a是一種重要的炎癥介質(zhì)和趨化因子,通過與靶細(xì)胞表面C5aR的結(jié)合,發(fā)揮其生物學(xué)效應(yīng)[7]?盡管補(bǔ)體在移植排斥中的重要作用已有不少報道[8-9],但對于小分子C5a在臨床移植排斥中的作用機(jī)制并不清楚?本研究檢測了同種異基因腎移植術(shù)前?后外周血以及發(fā)生移植排斥反應(yīng)腎組織中IL-17和C5a的表達(dá)變化,并探討C5a對腎小管上皮細(xì)胞IL-17表達(dá)的調(diào)節(jié)作用?
1 資料與方法
1.1 一般資料 選擇2012年1月至2013年12月在本院泌尿外科接受同種異基因腎移植手術(shù)的患者20例,其中男11例,女9例;年齡24~58歲,平均(40.61±2.21)歲?移植腎組織標(biāo)本來源于同期臨床診斷為排斥反應(yīng)的腎組織標(biāo)本10份及無排斥反應(yīng)的正常腎組織標(biāo)本5份?
1.2 方法
1.2.1 流式細(xì)胞術(shù)(FCM)檢測 FCM檢測接受同種異體腎移植患者外周血中IL-17+T細(xì)胞的比例和C5a刺激后人腎小管上皮細(xì)胞系中的HK2細(xì)胞IL-17的表達(dá)情況?外周血中IL-17+T細(xì)胞的檢測:分別在腎移植手術(shù)前(即0h)及術(shù)后3?7d,抽取患者靜脈血4mL,EDTA-Na抗凝處理?將抗凝血用PBS倍比稀釋后,緩慢加入預(yù)加有2mL人外周血淋巴細(xì)胞分離液(天津?yàn)笊?的離心管中,2 000r/min離心20min,收集單個核細(xì)胞層?在含乙酰肉豆蔻佛波酯(phorbol myristate acetate,PMA)50ng/mL?蛋白轉(zhuǎn)運(yùn)阻斷劑(brefeldin A,BFA)10g/mL和離子霉素(ionomycin)500ng/mL的 RPMI1640完全培養(yǎng)基中培養(yǎng)4h后,收集細(xì)胞,加入別藻藍(lán)蛋白(allophycocyanin,APC)-抗人CD3(Biolegend)進(jìn)行表面染色,然后依次用4%多聚甲醛固定細(xì)胞15min,0.1%的皂素通透破膜20 min,再加入藻紅蛋白(phycoerythrin,PE)-抗人IL-17A(Biolegend)冰上避光反應(yīng)30min,FCM檢測各樣品CD3+亞群中IL-17+T細(xì)胞的百分率?C5a刺激后HK2細(xì)胞IL-17的表達(dá)檢測:HK2細(xì)胞以8×103個/孔接種于24孔細(xì)胞培養(yǎng)板中,貼壁6~8h;無血清培養(yǎng)基饑餓24h后,加入200ng/mL重組人C5a(Hycult biotech)刺激48h;收集細(xì)胞,按照上述方法進(jìn)行染色,FCM檢測各處理組細(xì)胞IL-17的表達(dá)情況?
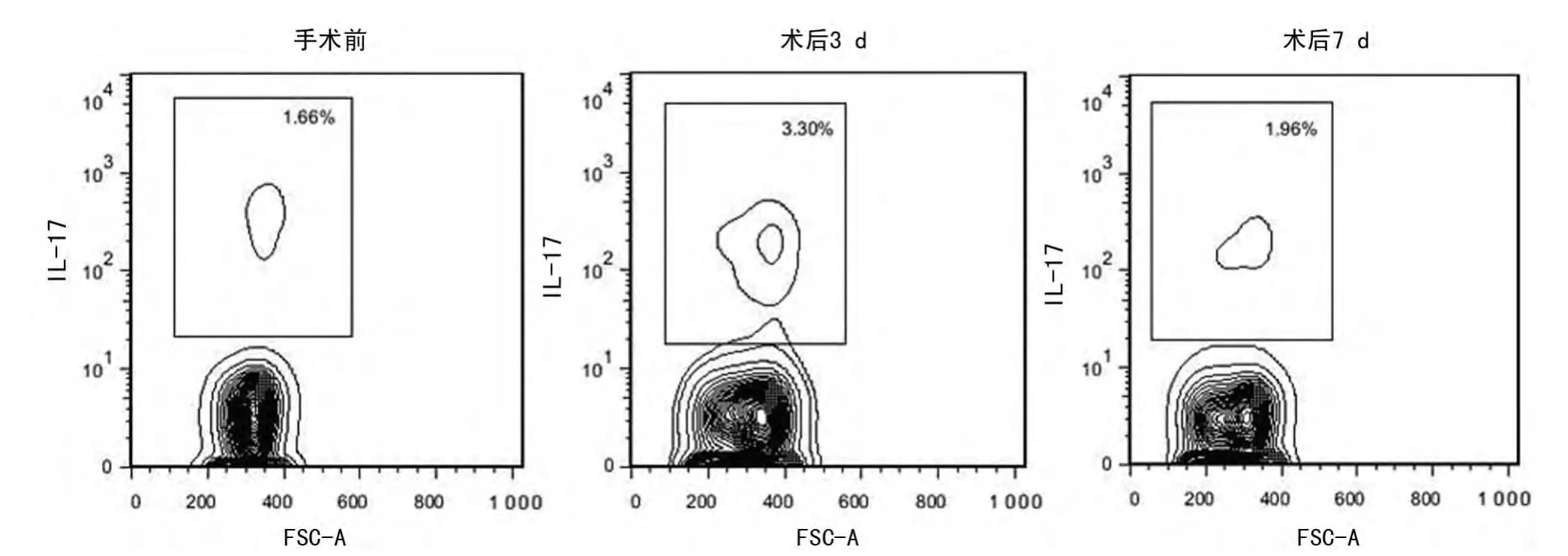
圖1 同種異基因腎移植手術(shù)前?后患者外周血中IL-17+T細(xì)胞百分率比較
1.2.2 ELISA技術(shù)檢測接受同種異體腎移植患者血清C5a的水平 采用BD公司的人C5aELISA檢測試劑盒,按照說明書測定血清C5a水平?
1.2.3 免疫組織化學(xué)和免疫細(xì)胞化學(xué)分別檢測組織及細(xì)胞中IL-17?C5b-9及C5aR的表達(dá) 免疫組織化學(xué):腎臟組織標(biāo)本常規(guī)方法進(jìn)行石蠟包埋?切片;組織切片脫蠟水化后,0.01 mol/L檸檬酸鈉微波法抗原修復(fù),然后用3%H2O2去除內(nèi)源性過氧化物酶;加入兔抗人IL-17多克隆抗體(SANTA CRUZ)和兔抗人C5b-9多克隆抗體(Abcam);二步法免疫組織化學(xué)檢測試劑盒(抗兔)PV-9000(中杉金橋)進(jìn)行后續(xù)染色;DAB試劑盒(中杉金橋)顯色后蘇木素復(fù)染;脫水透明后中性樹膠封片,拍片?免疫細(xì)胞化學(xué):HK2細(xì)胞以8×103個/孔接種于放有蓋玻片的24孔細(xì)胞培養(yǎng)板中,貼壁6~8h;無血清培養(yǎng)基饑餓24h后,加入200ng/mL重組人C5a(Hycult biotech)刺激48h;取出細(xì)胞爬片,4%多聚甲醛固定,3%H2O2去除內(nèi)源性過氧化物酶,正常山羊血清封閉;加入兔抗人IL-17多克隆抗體(SANTA CRUZ)和兔抗人C5aR單克隆抗體(Abcam);即用型免疫組織化學(xué)超敏(UltraSensitiveTM)SP(抗兔)試劑盒(福州邁新)進(jìn)行后續(xù)染色;DAB試劑盒(中杉金橋)顯色后蘇木素復(fù)染;中性樹膠封片后拍片?
1.3 統(tǒng)計學(xué)處理 采用GraphPad Prism 5.0進(jìn)行統(tǒng)計分析,計量資料以±s表示,統(tǒng)計分析采用非配對的t檢驗(yàn),以P0.05為差異有統(tǒng)計學(xué)意義?
2 結(jié) 果
2.1 同種異體腎移植手術(shù)前?后患者外周血細(xì)胞中IL-17+T細(xì)胞百分率比較 對患者外周血淋巴細(xì)胞進(jìn)行FCM的檢測,結(jié)果表明,接受同種異體腎移植患者外周血標(biāo)本中,部分患者術(shù)后3dIL-17+T細(xì)胞百分率較術(shù)前升高了約2倍(3.30%vs.1.66%),但術(shù)后7d時其頻率則下降到與手術(shù)前相當(dāng)水平(1.96%vs.1.66%),見圖1?
2.2 同種異體腎移植手術(shù)前?后患者血清C5a水平比較 對同種異體腎移植患者不同時相點(diǎn)血清中C5a水平進(jìn)行ELISA檢測,發(fā)現(xiàn)接受同種異體腎移植術(shù)后3d與手術(shù)前差異無統(tǒng)計學(xué)意義(P0.05);術(shù)后7d患者血清C5a水平較術(shù)前(即0h)顯著上升[(182.00±7.08)ng/mLvs.(116.50±15.95)ng/mL,P0.01],見圖2?表明移植術(shù)后補(bǔ)體C5被激活裂解形成了C5a?
2.3 不同腎臟組織中IL-17的表達(dá)與補(bǔ)體C5b-9沉積的比較正常腎組織和發(fā)生排斥反應(yīng)腎組織的免疫組織化學(xué)染色結(jié)果表明,發(fā)生排斥反應(yīng)移植腎組織中IL-17的表達(dá)(圖3)和C5b-9的沉積(圖4)較正常腎組織中明顯增加:10例有排斥反應(yīng)的患者腎組織IL-17表達(dá)均呈弱陽性,C5b-9的表達(dá)均呈強(qiáng)陽性;而5例無排斥反應(yīng)的正常腎組織中IL-17表達(dá)則為陰性,C5b-9的表達(dá)則為弱陽性?且二者表達(dá)方式相似,均主要表達(dá)于HK2細(xì)胞?
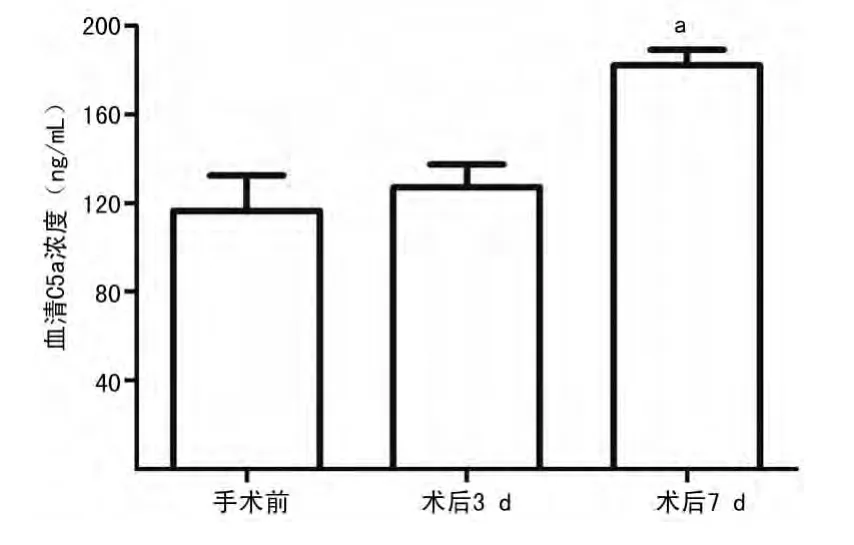
圖2 腎移植患者手術(shù)前?后血清C5a水平比較
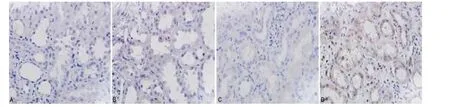
圖3 不同腎組織中IL-17的表達(dá)比較(×400)

圖4 不同腎組織中C5b-9沉積的比較(×400)
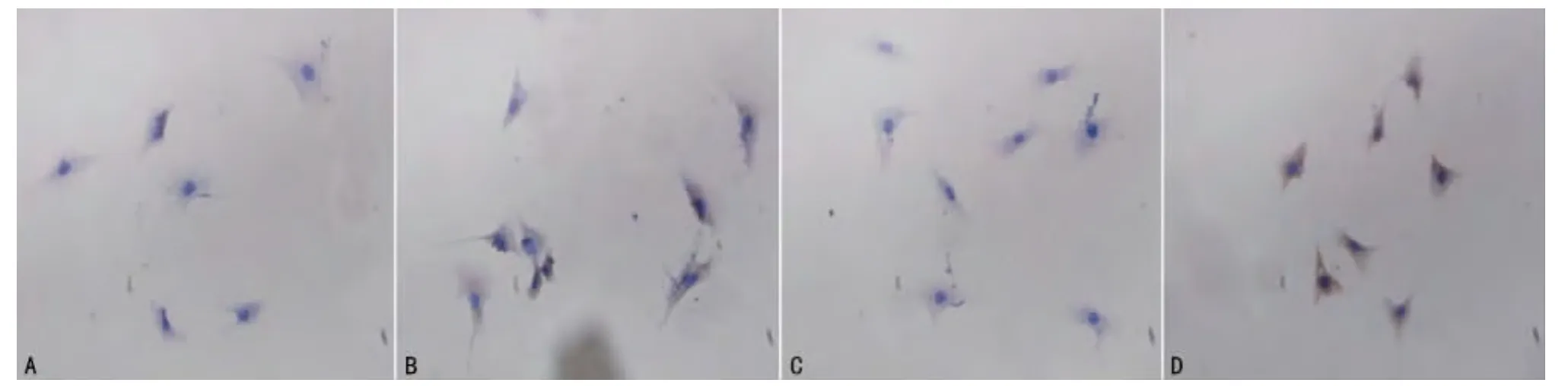
圖5 免疫細(xì)胞化學(xué)檢測HK2細(xì)胞IL-17表達(dá)
2.4 重組C5a對HK2細(xì)胞IL-17表達(dá)的誘導(dǎo)作用 對HK2細(xì)胞進(jìn)行C5a受體(C5aR)的細(xì)胞化學(xué)染色,結(jié)果證實(shí)該細(xì)胞可組成性地表達(dá)C5aR;再加入重組的C5a對HK2細(xì)胞進(jìn)行培養(yǎng),48h后收集細(xì)胞,通過免疫細(xì)胞化學(xué)和FCM分析IL-17的表達(dá),結(jié)果發(fā)現(xiàn)C5a刺激后,HK2表達(dá)IL-17的水平明顯上調(diào)(圖5?6),表明C5a可通過與C5aR結(jié)合,直接作用于HK2細(xì)胞調(diào)節(jié)其IL-17的產(chǎn)生?

圖6 FCM檢測C5a對HK2細(xì)胞IL-17表達(dá)的上調(diào)作用
3 討 論
近年來,中國每年由于各種原因?qū)е碌哪I衰竭新增患者約200萬人,雖然腎移植是治療終末期腎衰竭最理想的方法,但是,術(shù)后移植排斥已成為維持移植腎長期存活的主要障礙?目前,針對器官移植術(shù)后的排斥反應(yīng),臨床上采用的環(huán)孢素A和FK506等免疫抑制劑均是通過抑制整個T細(xì)胞群的活化和增殖來發(fā)揮作用,缺乏選擇性,不良反應(yīng)大[10]?因此,進(jìn)一步探討移植排斥的發(fā)生機(jī)制以發(fā)展新的治療方案已經(jīng)迫在眉睫?
移植排斥是一種炎癥反應(yīng),促炎性細(xì)胞因子IL-17在加速移植排斥中的重要作用也已得到越來越多實(shí)驗(yàn)數(shù)據(jù)的支持?Fábrega等[11]在同種異體肝移植模型中發(fā)現(xiàn),發(fā)生急性排斥反應(yīng)的小鼠血清中IL-17和IL-23顯著升高;Crispim等[12]在針對腎移植患者的研究發(fā)現(xiàn),移植后發(fā)生移植排斥的患者血清IL-17的水平顯著高于未發(fā)生排斥反應(yīng)的個體;IL-17在腎小管區(qū)可以通過細(xì)胞分裂素活化蛋白酶途徑誘導(dǎo)IL-6?IL-8和單核細(xì)胞趨化蛋白-1(monocyte chemotactic protein 1,MCP-1),介導(dǎo)排斥反應(yīng)[13]?本研究發(fā)現(xiàn),接受同種異體腎移植的患者,部分在接受移植術(shù)后,IL-17+T細(xì)胞的百分率較術(shù)前明顯升高(圖1),這可能是由于每對供體與受體主要組織相容性復(fù)合體(major histocompatibility complex,MHC)分子的相容性程度不一,因此臨床手術(shù)前普適劑量的免疫抑制劑會導(dǎo)致個體的排異程度在早期出現(xiàn)差異?隨著臨床免疫劑量和方案的調(diào)整,大多數(shù)患者IL-17+T細(xì)胞在術(shù)后7d恢復(fù)到手術(shù)前水平(圖1)?與之一致的是,在臨床上通過病理學(xué)診斷已確定發(fā)生排斥反應(yīng)的移植腎組織中HK2細(xì)胞IL-17的表達(dá)水平較正常腎組織有明顯的增強(qiáng),見圖3?
C5a與C5b均為補(bǔ)體C5活化后的裂解片段,但C5a存在于液相,不易在組織局部檢測到,而C5b形成后會依次與補(bǔ)體C6?C7?C8?C9結(jié)合,形成終產(chǎn)物C5b-9沉積于細(xì)胞表面,所以檢測C5b-9也可以間接反映C5a的產(chǎn)生?這在炎癥反應(yīng)的啟動和調(diào)節(jié)中起著關(guān)鍵作用?在同種異基因移植術(shù)中,補(bǔ)體的激活主要發(fā)生在以下兩種情況:(1)超急性排斥反應(yīng)階段,由于受者體內(nèi)預(yù)先存在的抗移植抗原的抗體與移植抗原結(jié)合,激活了補(bǔ)體,一般發(fā)生在移植術(shù)后數(shù)分鐘至數(shù)小時;(2)在急性排斥階段,受者體內(nèi)產(chǎn)生的抗體與移植抗原結(jié)合,導(dǎo)致補(bǔ)體激活,一般在移植術(shù)后7d左右出現(xiàn)?由于現(xiàn)在已具備成熟的受者體內(nèi)預(yù)存抗體的篩選手段,故前者在目前的臨床中基本可以避免,因此,移植排斥導(dǎo)致的補(bǔ)體激活主要發(fā)生在急性排斥反應(yīng)中?本研究也發(fā)現(xiàn),接受同種異體腎移植患者血清C5a水平在術(shù)后3d與術(shù)前差異無統(tǒng)計學(xué)意義(P0.05),但術(shù)后7d時顯著升高(圖2)?此外,與移植排斥腎組織中HK2細(xì)胞IL-17水平的高表達(dá)類似,補(bǔ)體C5的另一裂解片段C5b-9沉積的主要部位也是在移植排斥腎組織的HK2細(xì)胞(圖4),表明該部位為移植排斥導(dǎo)致補(bǔ)體活化的主要部位?腎移植排斥反應(yīng)中HK2細(xì)胞IL-17的產(chǎn)生與補(bǔ)體裂解片段C5a是否有著某種關(guān)聯(lián);有文獻(xiàn)報道C5aR組成性表達(dá)于原代腎上管上皮細(xì)胞以及包括HK2在內(nèi)的腎上管上皮細(xì)胞系[14-15]?本研究的體外細(xì)胞培養(yǎng)實(shí)驗(yàn)發(fā)現(xiàn),HK2細(xì)胞在接受重組C5a刺激后IL-17表達(dá)明顯上調(diào)(圖5?6),表明補(bǔ)體活化產(chǎn)物C5a可直接作用于HK2細(xì)胞誘導(dǎo)IL-17的產(chǎn)生,促進(jìn)排斥反應(yīng)?
該研究為補(bǔ)體C5a在移植腎損傷中的作用有了新的見解,為補(bǔ)體抑制劑治療移植相關(guān)疾病的使用提供了進(jìn)一步的理論依據(jù)?本研究的不足之處在于臨床總樣本量偏少,體外細(xì)胞實(shí)驗(yàn)中關(guān)于C5a/C5aR介導(dǎo)HK2細(xì)胞IL-17產(chǎn)生的信號通路有待進(jìn)一步的探討?
[1] Yan JW,Wang YJ,Peng WJ,et al.Therapeutic potential of interleukin-17in inflammation and autoimmune diseases[J].Expert Opin Ther Targets,2014,18(1):29-41.
[2] Xue Y,Yang Y,Su Z,et al.Local delivery of T-bet shRNA reduces inflammation in collagen II-induced arthritis via downregulation of IFN-γand IL-17[J].Mol Med Rep,2014,9(3):899-903.
[3] Cua DJ,Tato CM.Innate IL-17-producing cells:the sentinels of the immune system [J].Nat Rev Immunol,2010,10(7):479-489.
[4] Gor bacheva V,Fan R,Li X,et al.Interleukin-17promotes early allograft inflammation [J].Am J Pathol,2010,177(3):1265-1273.
[5] Vanaudenaerde BM,De Vleeschauwer SI,Vos R,et al.The role of the IL23/IL17axis in bronchiolitis obliterans syndrome after lung transplantation[J].Am J Transplant,2008,8(9):1911-1920.
[6] Ruttens D,Wauters E,Kicinski M,et al.Genetic variation in interleukin-17receptor A is functionally associated with chronic rejection after lung transplantation[J].J Heart Lung Transplant,2013,32(12):1233-1240.
[7] Klos A,Tenner AJ,Johswich KO,et al.The role of the anaphylatoxins in health and disease[J].Mol Immunol,2009,46(14):2753-2766.
[8] Farrar CA,Sacks SH.Mechanisms of rejection:role of complement[J].Curr Opin Organ Transplant,2014,19(1):8-13.
[9] Farrar CA,Kupiec-Weglinski JW,Sacks SH.The innate immune system and transplantation[J].Cold Spring Harb Perspect Med,2013,3(10):a015479.
[10]Ho S,Clipstone N,Timmermann L,et al.The mechanism of action of cyclosporin A and FK506[J].Clin Immunol Immunopathol,1996,80(3):40-45.
[11]Fábrega E,López-Hoyos M,San Segundo D,et al.Changes in the serum levels of interleukin-17/interleukin-23 during acute rejection in liver transplantation[J].Liver Transpl,2009,15(6):629-633.
[12]Crispim JC,Grespan R,Martelli-Palomino G,et al.Interleukin-17and kidney allograft outcome[J].Transplant Proc,2009,41(5):1562-1564.
[13]Loverre A,Tataranni T,Castellano G,et al.IL-17expression by tubular epithelial cells in renal transplant recipients with acute antibody-mediated rejection[J].Am J Transplantat,2011,11(6):1248-1259.
[14]Zahedi R,Braun M,Wetsel RA,et al.The C5areceptor is expressed by human renal proximal tubular epithelial cells[J].Clin Exp Immunol,2000,121(2):226-233.
[15]Fayyazi A,Scheel O,Werfel T,et al.The C5areceptor is expressed in normal renal proximal tubular but not in normal pulmonary or hepatic epithelial cells[J].Immunology,2000,99(1):38-45.
Regulation effect of complement C5a on interleukin-17 during renal allograft rejection*
ObjectiveTo investigate the expression of proinflammatory cytokine interleukin-17(IL-17)and complement cleavage fragment C5aand the regulation effect of C5aon the expression of IL-17during renal allograft rejection.MethodsThe frequency of IL-17+T cell in peripheral blood and the expression of IL-17in renal tubular epithelial cells(HK2)after C5astimulation in renal transplant recipients were measured by flow cytometry and the changes of serum C5alevel was detected by ELISA,respectively.Immunohistochemistry was applied to detect and compare the expression of IL-17and the deposition of C5b-9in normal renal tissues and renal tissues with allograft rejection.The difference of IL-17expression in HK2cells before and after the recombinant C5a stimulation was detected by immunocytochemistry.ResultsBoth the percentage of IL-17+T cells and serum C5alevels were significantly increased after the allogeneic renal transplantation.Compared with normal renal tissues,both the deposition of C5b-9and the IL-17expression in renal tissues with allograft rejection was remarkably up-regulated,which showed the positive correlation between them.The expression of IL-17in HK2was obviously up-regulated by the recombinant C5astimulation.ConclusionC5amay positively regulate the expression of IL-17by tubular epithelial cells during the renal allograft rejection.
complement C5a;interleukin-17;kidney transplantation;graft rejection
10.3969/j.issn.1671-8348.2014.11.018
A
1671-8348(2014)11-1331-04
* 基金項(xiàng)目:國家自然科學(xué)基金面上資助項(xiàng)目(81170695,81370846)?
李蜀婧(1983-),技師,碩士研究生,主要從事移植免疫方面的研究?△
,Tel:(023)68757941;E-mail:zhkq2000@sina.com?
2013-11-28
2014-01-22)
論著?臨床研究

