鹽酸千金藤堿逆轉(zhuǎn)MCF-7/ADR細(xì)胞多藥耐藥性的作用及其機(jī)制
夏 薇,王 寧,王慶端
(河南省醫(yī)藥科學(xué)研究院藥化室,鄭州 450052)
鹽酸千金藤堿逆轉(zhuǎn)MCF-7/ADR細(xì)胞多藥耐藥性的作用及其機(jī)制
夏 薇,王 寧,王慶端△
(河南省醫(yī)藥科學(xué)研究院藥化室,鄭州 450052)
目的研究鹽酸千金藤堿(CH)對(duì)人乳腺上皮細(xì)胞癌耐藥細(xì)胞株MCF-7/阿霉素(ADR)多藥耐藥性的體外逆轉(zhuǎn)作用,并探討其逆轉(zhuǎn)機(jī)制?方法 用四甲基偶氮唑鹽(M TT)法檢測(cè)CH對(duì)多藥耐藥腫瘤細(xì)胞MCF-7/ADR的耐藥逆轉(zhuǎn)活性;免疫組織化學(xué)法檢測(cè)細(xì)胞內(nèi)谷胱甘肽硫轉(zhuǎn)移酶π(GST-π)的表達(dá);通過(guò)對(duì)超螺旋PBR322 DNA的解旋能力檢測(cè)拓?fù)洚悩?gòu)酶Ⅱ(TopoⅡ)的活性?結(jié)果CH在無(wú)細(xì)胞毒濃度下具有逆轉(zhuǎn)MCF-7/ADR細(xì)胞耐藥性的作用,逆轉(zhuǎn)倍數(shù)為13.5倍,但對(duì)敏感株MCF-7細(xì)胞的抗癌藥物敏感性基本無(wú)影響?CH 4μ mol/L使MCF-7/ADR細(xì)胞中過(guò)度表達(dá)的GST-π的表達(dá)水平下降及DNA TopoⅡ的催化活性提高,但對(duì)敏感株MCF-7細(xì)胞無(wú)影響?結(jié)論CH具有逆轉(zhuǎn)多藥耐藥性的作用,其機(jī)制可能與降低GST-π的表達(dá)及提高DNA TopoⅡ的活性有關(guān)?
乳腺腫瘤;抗藥性,多藥;谷胱甘肽轉(zhuǎn)移酶;DNA拓?fù)洚悩?gòu)酶;鹽酸千金藤堿
腫瘤多藥耐藥性(multidrug resistance,M DR)是腫瘤化療失敗的主要原因,谷胱甘肽硫轉(zhuǎn)移酶π(glutathione S-transferase pi,GST-π)通過(guò)對(duì)異生物質(zhì)的生物轉(zhuǎn)化和解毒功能參與腫瘤細(xì)胞耐藥性的形成[1];而DNA拓?fù)洚悩?gòu)酶Ⅱ(topoisomeraseⅡ,TopoⅡ)活性數(shù)量或性質(zhì)上的改變引起藥物誘導(dǎo)產(chǎn)生的可裂解復(fù)合物的形成減少,從而導(dǎo)致MDR的產(chǎn)生[2]?鹽酸千金藤堿(cepharanthine hydrochloride,CH)是從防己科千金藤屬植物的塊根中提取分離出的一種雙芐基異喹啉類(lèi)生物堿單體化合物,具有較強(qiáng)的多種生物活性[3],其分子式為C37H38N2O6?HCl,相對(duì)分子質(zhì)量為679.628,現(xiàn)國(guó)家食品藥品監(jiān)督管理局(SFDA)已批準(zhǔn)進(jìn)入Ⅱ期臨床研究(臨床批號(hào):2005L00390)?有研究表明千金藤堿具有逆轉(zhuǎn)腫瘤MDR的作用[4]?但其機(jī)制是否與GST-π及DNA TopoⅡ有關(guān)的研究尚無(wú)報(bào)道?本研究旨在探討CH對(duì)人乳腺上皮細(xì)胞癌M DR細(xì)胞M CF-7/阿霉素(adriamycin,ADR)耐藥性的逆轉(zhuǎn)作用及其逆轉(zhuǎn)機(jī)制?
1 材料與方法
1.1 細(xì)胞株與細(xì)胞培養(yǎng) 人乳腺上皮細(xì)胞腺癌MCF-7細(xì)胞株及耐ADR細(xì)胞株MCF-7/ADR均引自中國(guó)科學(xué)院上海藥物研究所?兩細(xì)胞株培養(yǎng)于含體積分?jǐn)?shù)10%胎牛血清,1×105U/L青霉素和100 mg/L鏈霉素的RPMI-1640完全培養(yǎng)基中,置于37℃?飽和濕度及5%CO2的細(xì)胞培養(yǎng)箱內(nèi)?細(xì)胞經(jīng)消化傳代,取對(duì)數(shù)生長(zhǎng)期細(xì)胞進(jìn)行培養(yǎng),MCF-7/ADR細(xì)胞傳代時(shí)在完全培養(yǎng)基中加入2 μ mol/L ADR以維持其MDR表型,實(shí)驗(yàn)前無(wú)藥培養(yǎng)2周?
1.2 材料與儀器 CH為河南省醫(yī)藥科學(xué)研究院?中科院昆明植物研究所和廣州暨南大學(xué)共同研究并提供,經(jīng)檢測(cè)達(dá)質(zhì)譜純?ADR為意大利Farmitalia公司產(chǎn)品,RPMI-1640培養(yǎng)基為美國(guó)Gibco產(chǎn)品,四甲基偶氮唑鹽(M TT)為瑞士Fluka公司產(chǎn)品,兔抗人GST-π多克隆抗體?SP免疫組化染色試劑盒?DAB試劑盒購(gòu)自北京中杉金橋生物技術(shù)有限公司,pBR322DNA為華美生物工程公司產(chǎn)品?DNA expert自動(dòng)酶聯(lián)免疫檢測(cè)儀為奧地利Tecan公司產(chǎn)品,HPIAS-1000彩色病理圖文分析系統(tǒng)為同濟(jì)醫(yī)科大學(xué)千屏影像工程公司提供,Gene Genius凝膠圖像分析系統(tǒng)為英國(guó)Syugene公司產(chǎn)品?
1.3 M TT法測(cè)定藥物的細(xì)胞毒作用[5]取對(duì)數(shù)生長(zhǎng)期MCF-7?M CF-7/ADR細(xì)胞,制成細(xì)胞濃度8×107個(gè)/L的細(xì)胞懸液,接種于96孔細(xì)胞培養(yǎng)板,每孔100μL,培養(yǎng)24 h待細(xì)胞貼壁后,更換培養(yǎng)液,加入不同濃度的ADR?CH或維拉帕米(Verapamil,VER),每孔終體積為200 μ L,每組4個(gè)平行孔,細(xì)胞與藥物作用72 h后每孔加入M TT溶液(5 g/L)20μ L,繼續(xù)培養(yǎng)4 h,棄去孔內(nèi)培養(yǎng)液,加入二甲亞砜(DMSO)150 μ L/孔,用微量振蕩器振蕩10 min,完全溶解后用酶聯(lián)免疫檢測(cè)儀在570 nm波長(zhǎng)處測(cè)定吸光度值(A值)?計(jì)算抑制率?半數(shù)抑制濃度(IC50)?耐藥倍數(shù)(耐藥株 IC50/敏感株 IC50)?逆轉(zhuǎn)倍數(shù)(耐藥株IC50/加逆轉(zhuǎn)劑后耐藥株IC50)等?
1.4 細(xì)胞內(nèi)GST-π表達(dá)的測(cè)定[6]運(yùn)用免疫組化第二代LAB-SA檢測(cè)技術(shù)測(cè)定GST-π的表達(dá),并加以改進(jìn)?處理蓋玻片制備細(xì)胞爬片,取對(duì)數(shù)生長(zhǎng)期細(xì)胞 MCF-7?MCF-7/ADR,以細(xì)胞數(shù)5×108個(gè)/L植入放有蓋玻片的 24孔培養(yǎng)板,每孔 1 mL,培養(yǎng)24 h后,更換為含有不同濃度藥物的培養(yǎng)液,繼續(xù)培養(yǎng)12 h,取出蓋玻片,用 PBS(0.01 M?pH7.4)液洗滌2次,4℃丙酮固定10 min,PBS洗滌3次后,按試劑盒說(shuō)明書(shū)操作,一抗為1∶100兔抗人GST-π多克隆抗體,PBS代替一抗作為陰性對(duì)照?采用HPIAS-1000型彩色病理圖文分析系統(tǒng)進(jìn)行圖像分析,于400倍顯微鏡下各測(cè)定7個(gè)視域細(xì)胞中GST-π的含量,以細(xì)胞積分光密度值對(duì)結(jié)果進(jìn)行評(píng)價(jià)?
1.5 DNA TopoⅡ活性的測(cè)定 細(xì)胞培養(yǎng)及藥物處理分組同前,經(jīng)不同濃度藥物作用24 h后,收集 MCF-7?MCF-7/ADR細(xì)胞各5×107個(gè),按照文獻(xiàn)[7]的方法,加以改進(jìn)提取拓?fù)洚悩?gòu)酶?采用考馬斯亮藍(lán)法定量測(cè)定酶提取液的蛋白含量?按照文獻(xiàn)[8]的方法,以pBR322DNA為底物觀(guān)察耐藥株及敏感株細(xì)胞DNA TopoⅡ?qū)BR322DNA的解旋能力及藥物對(duì)其影響?將瓊脂糖凝膠電泳結(jié)果用Gene Genius凝膠圖相分析系統(tǒng)照相并對(duì)超螺旋DNA條帶進(jìn)行半定量分析,以加酶組與空白對(duì)照組的吸光度比值作為DNA TopoⅡ活性量化指標(biāo)?
1.6 統(tǒng)計(jì)學(xué)處理 采用SPSS10.0統(tǒng)計(jì)軟件分析,實(shí)驗(yàn)數(shù)據(jù)以±s表示,各參數(shù)多個(gè)樣本均數(shù)比較用單因素方差分析,兩樣本均數(shù)比較用t檢驗(yàn),進(jìn)行統(tǒng)計(jì)學(xué)處理?
2 結(jié) 果
2.1 多藥耐藥細(xì)胞株MCF-7/ADR的耐藥性測(cè)定 ADR對(duì)
MCF-7/ADR及MCF-7細(xì)胞的IC50值分別為(27.37±0.83)?(0.50±0.03)μ mol/L?耐藥倍數(shù)為54.7倍?
2.2 CH體外逆轉(zhuǎn)耐藥性的作用 CH在體外對(duì)MCF-7及MCF-7/ADR細(xì)胞毒作用較弱,8 μ mol/L CH的抑制率分別為(9.86±2.03)%?(10.27±1.25)%,4 μ mol/L CH 時(shí)分別為(4.75±0.58)%?(5.10 ±0.82)%,2 μ mol/L CH 時(shí)分別為(2.15±0.47)%?(2.34±0.71)%,在逆轉(zhuǎn)耐藥性所用的濃度下,基本不影響細(xì)胞存活率?CH可部分增加MCF-7/ADR對(duì)ADR的敏感性,對(duì)敏感株 MCF-7細(xì)胞無(wú)影響?4 μ mol/L CH對(duì)M CF-7/ADR細(xì)胞耐藥性的逆轉(zhuǎn)倍數(shù)為 13.5倍,而 8 μ mol/L VER的逆轉(zhuǎn)倍數(shù)為7.3倍,CH對(duì)MCF-7/ADR的逆轉(zhuǎn)活性強(qiáng)于 VER(P0.05),見(jiàn)表1?
2.3 CH對(duì)MCF-7/ADR細(xì)胞質(zhì)GST-π表達(dá)的影響 MCF-7及M CF-7/ADR細(xì)胞中 GST-π均有表達(dá),但 MCF-7/ADR細(xì)胞中GST-π呈高表達(dá),而 MCF-7細(xì)胞中GST-π呈較低表達(dá),兩者相比差異有統(tǒng)計(jì)學(xué)意義(P0.05)?單用0.17 μ mol/L ADR處理MCF-7細(xì)胞及單用 9.12 μ mol/L ADR處理MCF-7/ADR細(xì)胞均不影響 GST-π 表達(dá),與 4 μ mol/L CH 合用后可降低 MCF-7/ADR細(xì)胞中GST-π的表達(dá)水平(P0.05),但未下降至敏感細(xì)胞水平,而對(duì)MCF-7細(xì)胞無(wú)影響?與8 μ mol/L VER合用后也降低 MCF-7/ADR細(xì)胞中 GST-π的表達(dá)水平,但作用弱于CH,對(duì)敏感細(xì)胞無(wú)影響,見(jiàn)表2?
表1 CH對(duì)MCF-7及MCF-7/ADR敏感性的影響(±s,n=12)
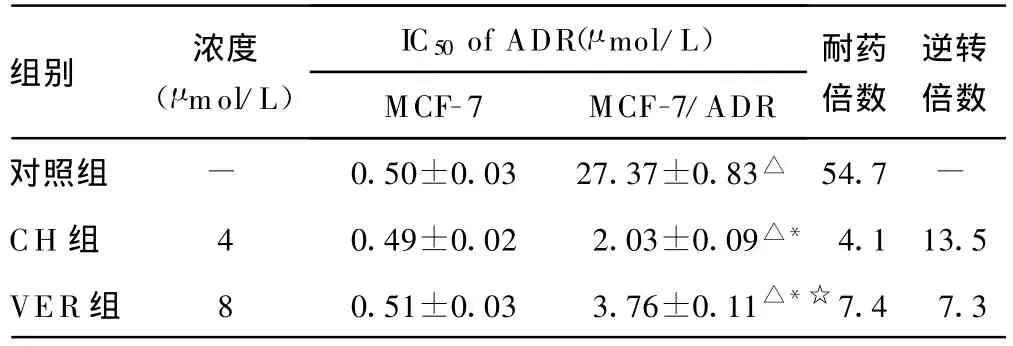
表1 CH對(duì)MCF-7及MCF-7/ADR敏感性的影響(±s,n=12)
△:P0.05,與同組 MCF-7比較;*:P0.05,與對(duì)照組MCF-7/ADR比較;☆:P0.05,與CH 組MCF-7/ADR比較;-:表示無(wú)數(shù)據(jù)?
組別 濃度(μ mol/L)IC50of ADR(μ mol/L)MCF-7 MCF-7/ADR耐藥倍數(shù)逆轉(zhuǎn)倍數(shù)對(duì)照組 - 0.50±0.03 27.37±0.83△ 54.7 -CH 組 4 0.49±0.02 2.03±0.09△* 4.113.5 VER組 8 0.51±0.03 3.76±0.11△*☆7.4 7.3
表2 CH對(duì) MCF-7及MCF-7/ADR細(xì)胞中GST-π表達(dá)的影響(±s,n=7)
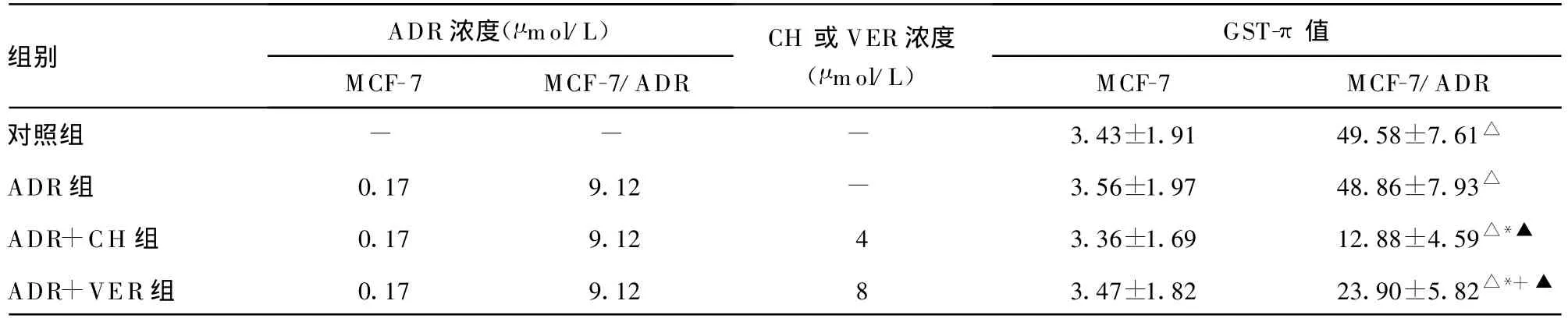
表2 CH對(duì) MCF-7及MCF-7/ADR細(xì)胞中GST-π表達(dá)的影響(±s,n=7)
△:P0.05,與同組MCF-7比較;*:P0.05,與對(duì)照組MCF-7/ADR比較;+:P0.05,與ADR+CH 組MCF-7/ADR組比較;▲:P0.05,與ADR組MCF-7/ADR比較;-:表示無(wú)數(shù)據(jù)?
組別ADR 濃度(μ mol/L)MCF-7 MCF-7/ADR CH或VER濃度(μ mol/L)GST-π值MCF-7 MCF-7/ADR對(duì)照組 - - - 3.43±1.91 49.58±7.61△ADR組 0.17 9.12 - 3.56±1.97 48.86±7.93△ADR+CH 組 0.17 9.12 4 3.36±1.69 12.88±4.59△*▲ADR+VER組 0.17 9.12 8 3.47±1.82 23.90±5.82△*+▲
表3 CH對(duì)MCF-7及MCF-7/ADR細(xì)胞DNA TopoⅡ催化活性的影響(±s,n=10)
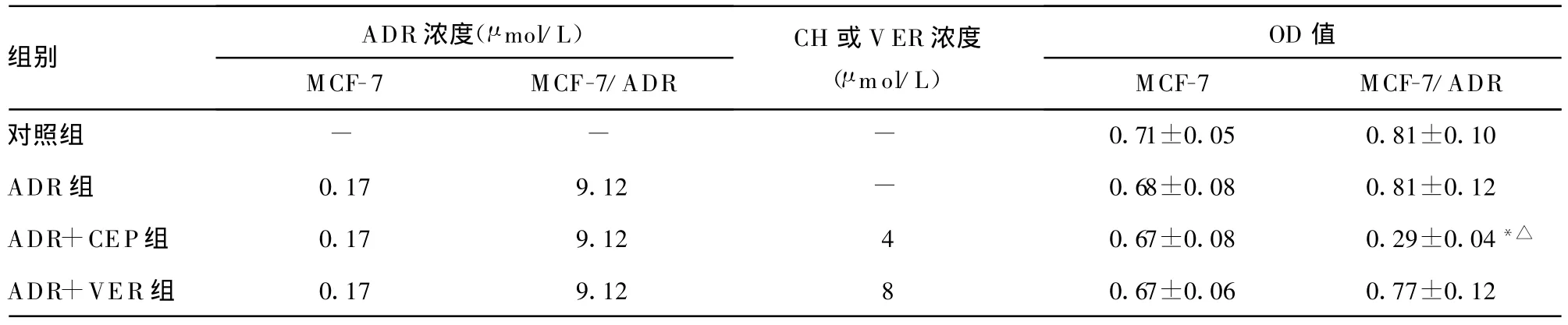
表3 CH對(duì)MCF-7及MCF-7/ADR細(xì)胞DNA TopoⅡ催化活性的影響(±s,n=10)
*:P0.05,與對(duì)照組MCF-7/ADR比較;△:P0.05,與ADR組MCF-7/ADR組比較;-:表示無(wú)數(shù)據(jù)?
組別 ADR濃度(μ mol/L)MCF-7 MCF-7/ADR CH或V ER濃度(μ mol/L)OD值MCF-7 MCF-7/ADR對(duì)照組 - - - 0.71±0.05 0.81±0.10 ADR組 0.17 9.12 - 0.68±0.08 0.81±0.12 ADR+CEP組 0.17 9.12 4 0.67±0.08 0.29±0.04*△ADR+VER組 0.17 9.12 8 0.67±0.06 0.77±0.12
2.4 CH對(duì)MCF-7/ADR細(xì)胞核內(nèi)DNA TopoⅡ催化活性的影響 DNA TopoⅡ催化活性測(cè)定結(jié)果表明,單用0.17 μ mol/L ADR處理 MCF-7細(xì)胞及單用9.12 μ mol/L ADR處理MCF-7/ADR細(xì)胞,與加酶無(wú)藥對(duì)照組相比差異均無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)?與4 μ mol/L CH 合用可促進(jìn)MCF-7/ADR細(xì)胞DNA TopoⅡ介導(dǎo)的 DNA解旋作用,而對(duì)MCF-7細(xì)胞無(wú)影響?與8 μ mol/L VER合用對(duì)MCF-7及MCF-7/ADR細(xì)胞DNA TopoⅡ活性均無(wú)影響,見(jiàn)表3?圖1?根據(jù)1個(gè)酶活性單位所需蛋白含量,MCF-7/ADR細(xì)胞為 MCF-7細(xì)胞的2.4倍,蛋白含量分別為(2.93±0.25)μ g和(1.22±0.16)μ g?
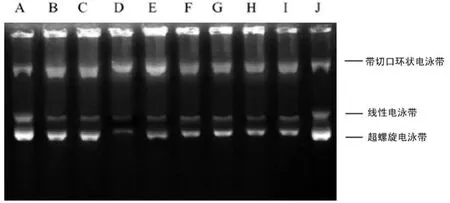
圖 1 MCF-7及MCF-7/ADR細(xì)胞DNA TopoⅡ催化活性
3 討 論
腫瘤M DR的發(fā)生存在多機(jī)制?多途徑?多環(huán)節(jié),在抗腫瘤藥物殺傷腫瘤細(xì)胞的通道上發(fā)生任何改變均可導(dǎo)致抗藥性的產(chǎn)生,涉及抗癌藥物的轉(zhuǎn)運(yùn)?代謝和抗癌藥物作用靶點(diǎn),細(xì)胞識(shí)別毒性損傷,細(xì)胞損傷修復(fù)機(jī)制以及細(xì)胞凋亡等[9]?近年來(lái)研究顯示以胞漿中谷胱甘肽硫轉(zhuǎn)移酶(GSTs)介導(dǎo)的MDR和以細(xì)胞核內(nèi)酶TopoⅡ介導(dǎo)的非經(jīng)典耐藥途徑(AT-MDR),在MDR的發(fā)生過(guò)程中發(fā)揮重要作用[10-11]?
本實(shí)驗(yàn)所用的MCF-7/ADR細(xì)胞由對(duì)人乳腺癌細(xì)胞MCF-7經(jīng)遞增濃度的ADR反復(fù)誘導(dǎo)篩選獲得的具典型MDR表型的細(xì)胞株?通過(guò)對(duì)兩細(xì)胞株活性的測(cè)定,MCF-7/ADR細(xì)胞相對(duì)于親代敏感細(xì)胞MCF-7耐藥倍數(shù)為54.7倍?體外逆轉(zhuǎn)活性表明CH對(duì)MCF-7/ADR的耐藥性有明顯的逆轉(zhuǎn)作用?在非細(xì)胞毒劑量下的CH?VER可增加MCF-7/ADR細(xì)胞對(duì) ADR的敏感性,4 μ mol/L CH的逆轉(zhuǎn)倍數(shù)為 13.5,8 μ mol/L VER的逆轉(zhuǎn)倍數(shù)為7.3,CH的逆轉(zhuǎn)作用強(qiáng)于VER?
GSTs是一組具有多種生理功能的同工酶蛋白,對(duì)異生物質(zhì)的生物轉(zhuǎn)化和解毒具有重要作用,主要存在于細(xì)胞質(zhì)中?GST-π基因表達(dá)受多水平調(diào)控,在多種耐藥性腫瘤細(xì)胞株中過(guò)量表達(dá),與腫瘤細(xì)胞的耐藥性密切相關(guān)[12]?GST-π可催化GSH的巰基與親電性抗腫瘤藥物結(jié)合,消除原來(lái)的活性親電部位,增加藥物在水中的溶解度,降低其化學(xué)反應(yīng),水溶性谷胱甘肽-S-化合物經(jīng)巰基尿酸生物合成途徑代謝,加速抗腫瘤藥物的降解,使藥物在靶部位的積蓄量迅速減少而達(dá)不到致死濃度,導(dǎo)致腫瘤MDR的產(chǎn)生[13]?
DNA TopoⅡ是催化DNA拓?fù)浣Y(jié)構(gòu)改變的酶,為核基質(zhì)成分之一,是腫瘤化療的重要靶酶,與多種抗癌藥物的細(xì)胞毒效應(yīng)有關(guān)[14]?細(xì)胞對(duì)抗腫瘤藥物的敏感性依賴(lài)于靶酶的水平,通過(guò)對(duì)分離出的抗藥細(xì)胞核仁和核基質(zhì)的研究證實(shí),藥物敏感性的降低在于藥物誘導(dǎo)產(chǎn)生的可裂解復(fù)合物的形成減少;藥物引起的DNA斷裂減少和抗藥細(xì)胞毒性的降低為抗藥細(xì)胞內(nèi)TopoⅡ活性降低所致?TopoⅡ介導(dǎo)的at-MDR的生化基礎(chǔ)在于TopoⅡ活性數(shù)量或性質(zhì)上的改變[15]?(2):167-177.
本實(shí)驗(yàn)結(jié)果顯示,MCF-7/ADR細(xì)胞GST-π高表達(dá),為MCF-7細(xì)胞的14.5倍,進(jìn)一步證實(shí)GST-π高表達(dá)可導(dǎo)致MDR產(chǎn)生;而MCF-7/ADR細(xì)胞1個(gè)酶活性單位所需的蛋白含量為MCF-7細(xì)胞的2.4倍,DNA TopoⅡ的活性明顯降低,說(shuō)明腫瘤細(xì)胞耐藥性在一定程度上與TopoⅡ的含量和活性的下降有關(guān),與國(guó)外研究結(jié)果一致[16]?CH?VER均可降低MCF-7/ADR細(xì)胞GST-π的表達(dá),CH可提高DNA TopoⅡ的活性,而對(duì)敏感株MCF-7無(wú)明顯影響,表明CH逆轉(zhuǎn)M DR的機(jī)制可能與降低GST-π的表達(dá)及增加DNA TopoⅡ的活性有關(guān)?有研究表明,在乳腺癌中 GST-π與 MDR相關(guān)蛋白(MRP)?mdr1存在共表達(dá),而共表達(dá)是耐藥相關(guān)標(biāo)志受共同因子調(diào)控的證據(jù)[17],因此,VER能有效逆轉(zhuǎn)P-gp介導(dǎo)的耐藥,部分逆轉(zhuǎn) MRP介導(dǎo)的耐藥,可能是其在一定程度上降低GST-π表達(dá)的機(jī)制,但與 TopoⅡ介導(dǎo)的 at-MDR途徑無(wú)關(guān)?
GST-π的表達(dá)及TopoⅡ介導(dǎo)的at-MDR途徑,受多水平調(diào)控,作用通路具有復(fù)雜性,CH通過(guò)何種機(jī)制影響GST-π的表達(dá)及TopoⅡ的活性,有待進(jìn)一步研究?CH是從防己科千金藤屬植物提取出來(lái)的生物堿單體化合物,日本已用于治療臨床放?化療所致的白細(xì)胞減少20余年,大劑量用藥而未發(fā)現(xiàn)明顯毒副作用,對(duì)該藥進(jìn)一步研究并作為腫瘤化療的耐藥逆轉(zhuǎn)劑應(yīng)用于臨床提供了重要依據(jù)?
[1] Teodori E,Dei S,Scapecchi S,et al.The medicinal chemistry of multidrug resistance(M DR)reversing drugs[J].Farmaco,2002,57(5):385-415.
[2] Liem AA,Chamberlain M P,Wolf CR,et al.The role of signal transduction in cancer treatment and drug resistance[J].Eur J Surg Oncol,2002,28(6):679-684.
[3] 王金華,葉祖光,孫愛(ài)續(xù),等.粉防己堿逆轉(zhuǎn)耐阿霉素的人乳腺癌MCF-7細(xì)胞的抗凋亡作用[J].中國(guó)組織化學(xué)與細(xì)胞化學(xué)雜志,2000,9(4):436-440.
[4] 宋玉成,夏薇,江金花,等.鹽酸千金藤素逆轉(zhuǎn) EAC/ADR細(xì)胞多藥耐藥性的作用及其機(jī)制[J].藥學(xué)學(xué)報(bào),2005,40(3):204-207.
[5] 郭偉劍,李杰,沈兆忠,等.外源性 TNF-a基因聯(lián)合異博定?三苯氧胺逆轉(zhuǎn)多藥耐藥性[J].復(fù)旦學(xué)報(bào):醫(yī)學(xué)版,2001,28(2):141-144.
[6] 辛華.細(xì)胞生物學(xué)實(shí)驗(yàn)[M].北京:科學(xué)出版社,2001:81-86.
[7] Markovits J,Larsen AK,Segal-Bendirdjian E,et al.Inhibition of DNA topoisomerases I andⅡand induction of apoptosis by erbstatin and tyrphostin derviatives[J].Biochem Pharmacol,1994,48:549-560.
[8] Marx G,Zhou H,David E,et al.Covalent attachment of ethidium to DNA Results in enhanced topoisomeraseⅡ-mediated DNA cleavage[J].Biochemistry,1997,36:15884-15891.
[9] 李偉,胡凱文.腫瘤多藥耐藥研究現(xiàn)狀[J].中國(guó)中醫(yī)藥信息雜志,2000,7(7):68.
[10]Bernardini S,Bellincampi L,Ballerini S,et al.Role of GST P1-1 in mediating the effect of etoposide on human neuroblastoma cell line Sh-Sy5y[J].J Cell Biochem,2002,86(2):340-347.
[11]Goekkurt E,Hoehn S,Wolschke C,et al.Polymorphisms of glutathione S-transferases(GST)and thymidylate synthase(TS)-novel predictors for response and survival in gastric cancer patients[J].Br J Cancer,2006,94:281-286.
[12]王秀麗,孔力,趙瑾瑤,等.三氧化二砷逆轉(zhuǎn)人乳腺癌MCF-7/ADM細(xì)胞耐藥的機(jī)制研究[J].中華腫瘤雜志,2002,24(4):339-343.
[13]Ichihara T,Wanibuchi H,Taniyama T,et al.Inhibition of liver glut athione S-transferase placental form positive foci development in the rat hepatocarcino-genesis by Porphyra tenera(Asakusa-nori)[J].Cancer Lett,1999,141:211-218.
[14] Tanner B,Pilch H,Schaffer U,et al.Expression of C-erbB-2 and topoisomeraseⅡ alpha in rdlation to chemoresistance in ovarian cancer[J].Zentralbl Gynakol,2002,124(3):176-183.
[15]Korkolopoulou P,Angelopoulou M,Siakantari M,et al.Evalution of DNA topoisomeraseⅡa expression provides independent prognostic information in non-Hodgkin′s lymphomas[J].Histopathology,2001,38:45-53.
[16]Scheltema JMW,Romijn JC,Van Steenbragge GJ,et al.Inhibition of apoptotic proteins causes multidrug resistance in renal carcinoma cells[J].Anticancer Res,2001,21(5):3161-3166.
[17]Kreisholt J,Sorensen M,Jensen PB,et al.Immunohistochemical detection of DNA topoisomeraseⅡalpha P-glycoprotein and multidrugresistance protein(M RP)in small-cell and non-small-cell lung cancer[J].Br J Cancer,1998,77:1469-1473.
Reversal of multidrug resistance in MCF-7/ADR cells by cepharanthine hydrochloride and its mechanism
ObjectiveTo investigate the reversal effect of cepharanthine hydrochloride(CH)on multidrug resistance(MDR)of drug-resistant cell line of human breast epithelial carcimoma(MCF-7/ADR),and to explore its mechanism.MethodsM TT assay was used to detect cytotoxicity and MDR reversal activity of CH in MCF-7/ADR cell line.Immunohistochemistry(IHC)technique was used to show the intracellular expression of glutathione S-transferases pi(GST-π).The catalytic activity of DNA Topoisomerase(TopoⅡ)was assessed by the ATP-dependent relaxation of supercoild pBR322 DNA.ResultsCH could enhance sensitivity of MCF-7/ADR cells to anti-tumor drugs.A 13.5 fold reversed effect of resistance was achieved in vitro.However,CH had few effects on drug-sensitive MCF-7 cells.After treatment of CH under the concentration of 4μ mol/L,the level of higher expression of GST-π was decreased and the activity of DNA TopoⅡwas increased in MCF-7/ADR cell line,but no changes was found in MCF-7 cells.ConclusionCH is able to effectively reverse drug resistance and its mechanism is probably related to reducing the expression of GST-πand enhancing the activity of DNA TopoⅡ in MDR tumor cells.
breast neoplasms;drug resistance,multiple;glutathione transferase;DNA topoisomerase;cepharanthine hydrochloride
10.3969/j.issn.1671-8348.2011.01.006
A
1671-8348(2011)01-0014-03
△通訊作,電話(huà):(0371)66658216;E-mail:wangningxiao3@126.com?
2010-03-10
2010-06-23)
?論 著?

